VelAz eredmények hozzájárulhatnak számos autoimmun kór, pl. egyes vesebetegségek és a vaksághoz vezető időskori makuladegeneráció terápiájának kifejlesztéséhez. A felfedezésükről szóló közlemény a Nature lapcsaládba tartozó Scientific Reports szaklap hasábjain jelent meg 2016 augusztusábaneszületett immunitás, komplementrendszer
A veleszületett immunválasz elemei (molekulák, sejtek) – az ellenanyagokon, B- és T-sejteken alapuló, lassan szerveződő adaptív immunválasszal ellentétben – születésünk pillanatától kezdve folyamatosan készenlétben állnak, hogy veszély esetén akcióba lépjenek, és megvédjék szervezetünk épségét. A komplementrendszer a véralvadási rendszerrel rokonságot mutató fehérjehálózat, amely a veleszületett immunitás központi elemeként haladéktalanul támadást intéz a betolakodó kórokozókkal szemben. Fehérjebontó (proteináz) komponensei inaktív (zimogén) formában termelődnek, és csak veszély esetén aktiválódnak egy másik proteinázmolekula általi hasítás révén. Az aktivált proteinázok további zimogéneket hasítanak, ami egy lavinaszerű (kaszkád) folyamatban tömeges proteinázaktiválódáshoz vezet.
Ez az ősi rendszer létfontosságú védvonalat biztosít, amely azonban hibás szabályozása esetén a saját szervezetünket is megtámadhatja. A komplementrendszer három ágon, a klasszikus, a lektin- és az alternatív úton aktiválódhat, amelyek közös útvonalban végződnek.
Alternatív út, a D-faktor aktiválódásának rejtélye
A komplementrendszer legpusztítóbb ágának, az alternatív útnak a csúcsán a D-faktor nevű proteináz áll. Ez a kulcsfontosságú enzim kivételes módon nem zimogén, hanem eleve aktív állapotban található meg a keringésben. A D-faktor felfedezése óta, azaz mintegy hetven éve rejtély, hogy a vérben mi aktiválja ezt az enzimet.
Az enigmatikus MASP-3 proteináz
A komplementrendszer legkésőbb felfedezett proteináza a MASP-3. Az enzimet dán kutatók azonosították 2001-ben, és azonnal éles nemzetközi verseny indult a MASP-3 élettani szerepének kiderítésére. A feladat óriási kihívásnak bizonyult: 15 évnyi, kudarcokkal terhelt kutatás során egyetlen olyan MASP-3 által hasítható fehérjét sem azonosítottak, melynél a hasításnak bizonyíthatóan élettani jelentősége lett volna. A MASP-3 génjének kiütésén alapuló egérkísérletek, illetve örökletesen MASP-3-hiányos emberek vizsgálata ugyan arra utalt, hogy a MASP-3 enzimnek szerepe lehet az alternatív út aktiválásában, de ezek a kutatások komoly ellentmondásokhoz vezettek.
Magyar kutatók összefogása a rejtélyek megoldására
Unikális fejlesztéseinek köszönhetően végül egy hazai kutatógárda oldotta meg mindkét rejtélyt. Az ELTE Természettudományi Kar Biokémiai Tanszékének Pál Gábor által alapított Irányított Fehérje-evolúció Kutatócsoportja tíz éve működik sikeresen együtt a Magyar Tudományos Akadémia Természettudományi Kutatóközpont Gál Péter által vezetett Szerkezeti Biofizika Kutatócsoportjával. Utóbbi több évtizede kutatja az immunrendszer – azon belül is a komplementrendszer – működését. A hazai konzorcium négy éve határozta el, hogy megfejti a MASP-3 enzim szerepét.
A felfedezéshez vezető út: génsebészet, irányított evolúció, fluoreszcens nyomkövetés
A Pál Gábor és Gál Péter vezette konzorcium az MASP-3 élettani szerepének tisztázásához három kulcsfontosságú fejlesztést hajtott végre. Laboratóriumi körülmények közt baktériumokban termelve állítottak elő emberi MASP-3 enzimet aktív formában, nagy tisztaságban, génsebészeti módszereket alkalmazva. Mivel a természetben nem ismert MASP-3-gátlószer, a világon elsőként irányított fehérjeevolúcióval kifejlesztettek egy szelektív MASP-3-inhibitort. Emellett kifejlesztettek egy érzékeny mérési módszert, amellyel emberi vérben nyomon tudták követni a zimogén D-faktor aktiválódását. Ehhez a zimogén D-faktort rovarsejtekben termelték, és fluoreszcens festékkel jelölték. A fenti fejlesztéseket elsősorban Szakács Dávid (ELTE Biokémiai Tanszék), valamint Dobó József és Oroszlán Gábor (MTA TTK) végezte.
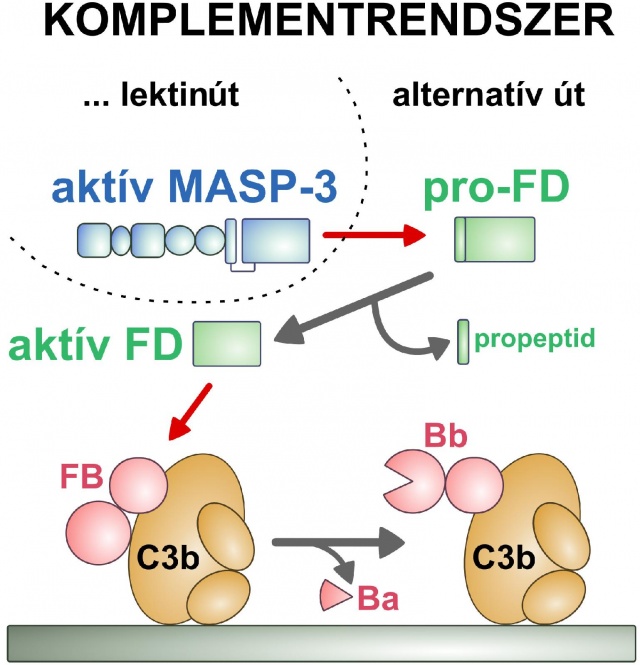 A D-faktor (FD) a komplementrendszer alternatív útvonalának kulcsenzime. Feladata az alternatív út beindítása a C3b-hez kötött B-faktor (FB) aktiválása által. Kódoló génjének szekvenciája alapján a D-faktor egy propeptidet is tartalmazó inaktív előalak (pro-FD) formában keletkezik. Ezzel szemben a D-faktor szinte kizárólag propeptidet nem hordozó, aktív formában kering a vérben. A magyar kutatók bebizonyították, hogy a vérbe jutó D-faktor előalakjának aktiválását kizárólag a komplementrendszer lektinútvonalának egyik proteinázkomponense, a korábban ismeretlen szerepű MASP-3 végzi. (Az ábrán a piros nyilak proteolitikus hasítást, a szürke nyilak átalakulást jelölnek.)Forrás: Pál Gábor és Gál Péter
A D-faktor (FD) a komplementrendszer alternatív útvonalának kulcsenzime. Feladata az alternatív út beindítása a C3b-hez kötött B-faktor (FB) aktiválása által. Kódoló génjének szekvenciája alapján a D-faktor egy propeptidet is tartalmazó inaktív előalak (pro-FD) formában keletkezik. Ezzel szemben a D-faktor szinte kizárólag propeptidet nem hordozó, aktív formában kering a vérben. A magyar kutatók bebizonyították, hogy a vérbe jutó D-faktor előalakjának aktiválását kizárólag a komplementrendszer lektinútvonalának egyik proteinázkomponense, a korábban ismeretlen szerepű MASP-3 végzi. (Az ábrán a piros nyilak proteolitikus hasítást, a szürke nyilak átalakulást jelölnek.)Forrás: Pál Gábor és Gál PéterA rejtélyek megoldása
A kísérletek megdöbbentő eredményre vezettek. Az evolvált szelektív MASP-3-inhibitor tökéletesen meggátolta, hogy az emberi vér eddig azonosítatlan proteináza aktiválja a zimogén D-faktort. A MASP-3 szerepének 15 éves és a D-faktor aktiválásának hetven éves rejtélye egy csapásra megoldódott. Minden kétséget kizáróan bizonyítást nyert, hogy nyugvó vérben (amelyben sem alvadás, sem gyulladás nem zajlik) a MASP-3 a zimogén D-faktor kizárólagos aktivátora. Ez a kettős áttörés és az alternatív út központi szerepe együttesen magyarázza a kutatás tudományos jelentőségét.
Jövőbeni tervek
A MASP-3 enzimmel kapcsolatos hazai kutatások két fő irányban folynak tovább. A tipikus proteinázszabályozást követve a MASP-3 is zimogén állapotban kerül ki a termelő sejtekből. Ebben az állapotában nem képes aktiválni a zimogén D-faktort. Először azt szeretnék tisztázni, hogy nyugvó vérben milyen proteináz aktiválja a zimogén MASP-3 enzimet. Egy másik fontos kérdés, hogy vajon a MASP-3 milyen egyéb fehérjéket képes hasítani. Genetikai vizsgálatok eredményei arra utalnak, hogy egy ritka, súlyos fejlődési rendellenesség, az ún. 3MC szindróma hátterében a MASP-3-gén olyan mutációi állnak, amelyek inaktiválják az enzimet. A betegség kialakulását eszerint az okozhatja, hogy bizonyos, csak vagy elsősorban a MASP-3 által hasított, egyedfejlődést szabályzó fehérjék processzálása elmarad. Az ELTE és az MTA kutatóinak célja ezeknek a fehérjéknek az azonosítása.
Terápiás jelentőség
A komplementrendszer mindhárom útja fontos szerepet tölt be a fertőzések elleni védekezésben. Amikor azonban az egyes utak szabályozása felborul, az a saját sejtek, szövetek pusztításához vezethet. Alzheimer-kórban például igazolt a klasszikus út, míg szívinfarktus és szélütés esetében a lektinút kóros szerepe. Az alternatív út bizonyítottan negatív szerepet játszik egyes vesebetegségek és a fejlett, elöregedő ipari társadalmakban leggyakrabban vaksághoz vezető kórkép, az időskori makuladegeneráció kialakulásában. Az alternatív úttal kapcsolatos betegségek kezelésére jelenleg általános (a végső, közös útvonalat blokkoló) komplementrendszer-gátlást vagy D-faktoron keresztüli alternatívút-gátlást próbálnak bevetni. Az új felfedezés arra hívja fel a figyelmet, hogy az alternatív útra szelektív stratégia esetében a D-faktor mellett a MASP-3 enzim is fontos gyógyszercélpont lehet.
Az ELTE sajtóközleménye itt érhető el.

